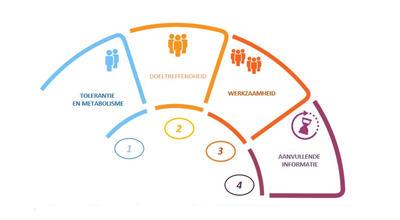
Het ontwikkelingsproces van een nieuw geneesmiddel kan wel 10 jaar duren en verloopt in verschillende fasen. Pas na een gunstige eerste fase kan het onderzoek naar een volgende fase overgaan. Na een gunstige derde fase kan toelating worden gevraagd om de innovatie op de markt te brengen.
Fase 1: Tolerantie en metabolisme
Na uitvoerig onderzoek in het laboratorium wordt de veiligheid en de werking van een product getest bij een kleine groep gezonde vrijwilligers. Indien het om zeer specifieke aandoeningen gaat worden geen gezonde vrijwilligers gezocht maar wel patiënten.
Men gaat na wat de veilige dosis is, wat nevenwerkingen zijn, hoe de opname in het bloed gebeurt, enz.
Fase 2: Doeltreffendheid
Men gaat na of het product effectief het verwachte resultaat oplevert. Het product wordt nu toegediend aan een kleine groep patiënten.
De optimale dosis wordt bepaald, ook het toedieningsschema wordt op punt gezet. De bijwerkingen worden verder in kaart gebracht en onderzocht, daarnaast wordt er in deze fase voor het eerst bestudeerd of het geneesmiddel ook het verwachte resultaat oplevert.
Fase 3: Werkzaamheid
In deze fase worden de eerder aangetoonde effectiviteit en veiligheid van het medicijn verder bestudeerd in een grote groep van patiënten over een langere tijdsduur.
Een groep van patiënten krijgt de standaard behandeling, een andere groep van patiënten het nieuwe product. In veel gevallen weet de patiënt en de arts niet welke behandeling gegeven wordt. Men noemt dit een geblindeerde studie.
Als het geneesmiddel in deze fase het gewenste resultaat oplevert kan het vervolgens geregistreerd worden en op de markt gebracht worden.
Fase 4: Aanvullende informatie
Eens het medicijn op de markt is worden bijkomende studies uitgevoerd om aanvullende informatie te verkrijgen.
Er wordt nu op zoek gegaan naar zeer zeldzame bijwerkingen en lange termijn-effecten. Ook de combinatie met andere medicijnen of toediening van het medicijn in zwakkere patiëntengroepen kunnen in deze fase onderzocht worden.